Permanganaat
|
Algemeen | |
|---|---|
| Naam | Permanganaat |
 |

|
| Termochemiese radius | 2,20(19) Å[1] |
| 61,3 [Scm2/mol][2] | |
| Lys van anione | |
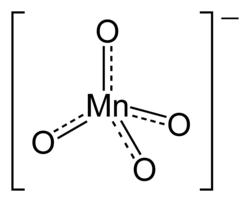
'n Permanganaat is 'n sout wat die komplekse ioon MnO4- as anioon bevat. Die anioon het die vorm van 'n tetraëder en die sentrale mangaanatoom het sy hoogste oksidasietoestand: 7+.
Die bekendste permanganaat is kaliumpermanganaat, 'n pers vastestof wat 'n sterk oksideermiddel is en goed in water oplos.
Redoksreaksies
In alkaliese oplossings voer die reduksie van permanganaat tot mangaandiokside (met oksidasietoestand 4+) volgens die halfreaksie
In suur oplossings voer dit tot die Mn2+-ioon
Gebruik
Oplossings van permanganaat word gebruik om die vel te ontsmet van plantaardige gifstowwe, maar is 'n kwaai hartgifstof[3]
Permanganaatoplossings word ook gebruik as etselektroliete om kunsstowwe 'n rowwe oppervlak te gee. Dit verbeter die hegting van 'n metaallaag wat daarop aangebring word.[4]
Sien ook
Verwysings
- ↑ Thermochemical Radii of Complex Ions Sjabloon:Outeur Journal of Chemical Education 76(11) 1999, bls. 1570
- ↑ Sjabloon:Webaanhaling
- ↑ Sjabloon:Cite web
- ↑ Sjabloon:Aut BBT voor het elektrolytisch behandelen en ontvetten met oplosmiddelen van metalen oppervlakken, 1998, ISBN 90-382-0157-5