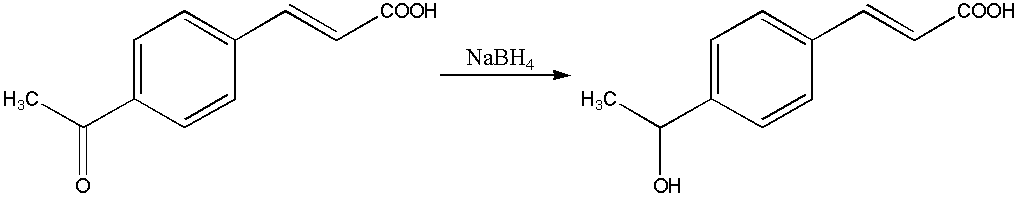Natriumboorhidried
Sjabloon:Chemiekas2 Natriumboorhydried (of natrium(tetra)hidroboraat)) is 'n gemengde hidried van natrium en boor met formule Sjabloon:Chem. Dit is 'n sterk reduseermiddel.
Die stof los op in water en dit is stabiel teen hoë pH. Met sure ontbind dit en vorm waterstof. Hoër temperature versnel die hidrolise.
Kristalstruktuur

Die verbinding het teen kamertemperatuur 'n wanordelike kristalstruktuur wat van tafelsout s'n afgelei is. (Strukturbericht-klassifikasie B1). Natriumione vorm 'n vlakgesentreerde kubus soos in NaCl. Boor word tetraëdries deur vier waterstofatome omring en die [[[:Sjabloon:Chem]]-ioon neem die plek van die chloorioon in, maar hulle oriëntasie kan wissel.[1]
Teen laer temperature soos 190K word die struktuur tetragonaal. Die oorgang is 'n faseoorgang van tweede orde.
Sintese

Daar is verskeie maniere om natriumboorhidried te maak.[1] Dit kan bv. uit diboraan en natriumhidried in 'n geskikte oplosmiddel vervaardig word. 'n Triëter soos diglyme (1-metoksie-2-(2-metoksietoksi)etaan) word gewoonlik as oplosmiddel gebruik.
'n Ander metode gebruik trimetielboraat Sjabloon:Chem as katalisator:
Hierdie proses verloop sonder oplosmiddel.
'n Mens kan ook van natriummetoksied Sjabloon:Chem uitgaan:
Chemiese eienskappe

Natriumboorhidried is goed oplosbaar in polêre oplosmiddels met 'n hoë diëlektriese konstante. In waterige oplossing vind hidrolise van die hidroboraat plaas, maar dit sal die oplossing basies maak en die hidrolise vertraag teen hoë pH. Die algemene reaksie is:
Dié hidrolise erhoog die pH en stel waterstof vry maar die meganisme is ten spyte van baie navorsing nie duidelik nie.
Die stof kan uit sterk basiese oplossing herkristalliseer word, wat as suiweringsmetode gebruik kan word. Onder 35 °C word 'n hidraat Sjabloon:Chem.2Sjabloon:Chem gevorm en dit kan in die oplosbaarheidskromme goed gesien word.
Natriumboorhidraat is 'n belangrike reagens in die organiese chemie. Dit reduseer 'n aldehied (alkanal) tot 'n primêre alkohol en 'n ketoon (alkanoon) tot 'n sekundêre.[2] In teenstelling tot litiumaluminiumhidried tas dit karboksielsure or esters nie aan nie:
Dit kan 'n imien reduseer: